L’hépatite auto-immune est une maladie chronique du foie où le système immunitaire attaque par erreur les cellules hépatiques. Contrairement aux hépatites virales, elle n’est pas causée par un virus, mais par une réaction immunitaire mal dirigée. Elle touche surtout les femmes - environ 4 fois plus que les hommes - et peut apparaître à n’importe quel âge, même si les pics sont entre 20 et 40 ans, puis entre 60 et 70 ans. En 2025, on estime qu’entre 10 et 25 personnes sur 100 000 en sont atteintes en Europe, et le nombre de cas ne cesse d’augmenter depuis les années 1990.
Comment diagnostique-t-on l’hépatite auto-immune ?
Pas de test unique. Pas de résultat de sang qui confirme tout seul. Le diagnostic repose sur une combinaison de signes : des analyses de sang, une biopsie du foie, et l’élimination d’autres causes comme l’alcool, les virus de l’hépatite B ou C, ou les maladies métaboliques.
Les marqueurs sanguins clés sont l’élévation de l’IgG (immunoglobuline G) - souvent 1,5 fois au-dessus de la norme - et la présence d’anticorps spécifiques : les ANA (anticorps antinucléaires) ou les SMA (anticorps anti-muscle lisse), présents dans 80 % des cas (type 1). Moins fréquents, les anticorps LKM1 indiquent le type 2, plus rare et souvent observé chez les enfants.
Depuis les nouvelles lignes directrices européennes de 2025, les médecins n’utilisent plus ces types d’anticorps pour décider du traitement. Pourquoi ? Parce qu’ils ne changent rien à la prise en charge. Ce qui compte, c’est la réponse au traitement, pas la signature auto-immune.
La biopsie du foie reste indispensable. Elle doit montrer une hépatite d’interface : une inflammation à la frontière entre les canaux portes et le parenchyme hépatique. Un minimum de 20 tracts portes doivent être examinés pour valider le diagnostic. Sans cela, on ne peut pas dire avec certitude qu’il s’agit d’une hépatite auto-immune.
Pour aider les médecins, on utilise un système de points : le score de l’IAIHG (International Autoimmune Hepatitis Group). Si vous avez plus de 15 points, c’est probablement une hépatite auto-immune. Plus de 20 ? C’est confirmé. Les enzymes hépatiques (ALT, AST) sont souvent élevées de 5 à 10 fois la norme au moment du diagnostic.
Le traitement de première ligne : stéroïdes et azathioprine
Depuis les années 1970, le traitement de référence est une combinaison de prednisone (ou prednisolone) et d’azathioprine. C’est la seule approche qui a prouvé qu’elle pouvait arrêter l’inflammation, prévenir la cirrhose, et même inverser les lésions du foie.
La prednisone commence à une dose de 0,5 à 1 mg par kg de poids par jour - jusqu’à 60 mg maximum. Elle est ensuite réduite progressivement, en 6 à 8 semaines, jusqu’à 10-15 mg par jour. L’azathioprine, elle, est ajoutée dès le début : 50 mg par jour, puis augmentée jusqu’à 1-2 mg par kg (max 150 mg/jour).
Le but ? Réduire les effets secondaires des stéroïdes. Sans azathioprine, 70 % des patients développent des effets indésirables : prise de poids, visage de lune, diabète, ostéoporose, cataractes. Avec la combinaison, ce taux tombe à 30 %. C’est pourquoi les médecins insistent : ne prenez pas les stéroïdes seul.
Les réponses au traitement varient. En 6 à 12 mois, 60 à 80 % des patients voient leurs enzymes hépatiques et leur taux d’IgG revenir à la normale. Ce qu’on appelle une réponse biochimique complète. Mais 20 à 40 % n’y parviennent pas - il faut alors ajuster le traitement.
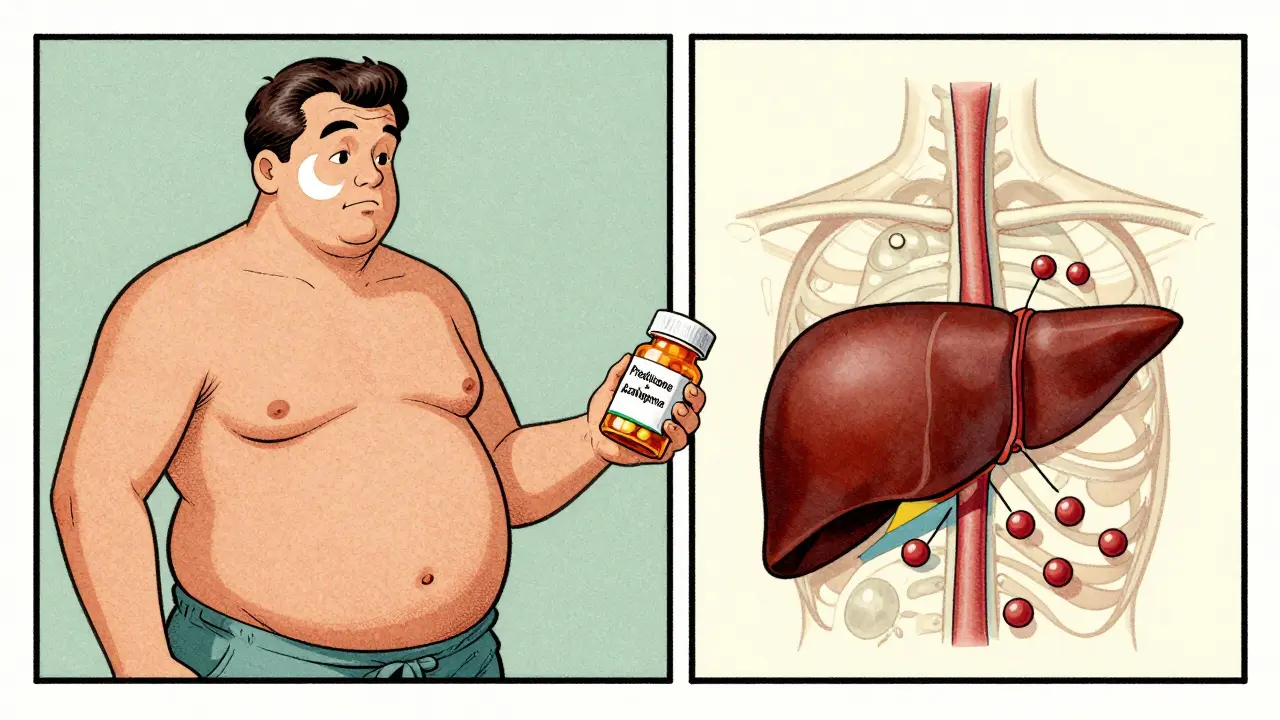
Les effets secondaires : un prix à payer
Les stéroïdes, même en faible dose, ont un lourd tribut. Beaucoup de patients décrivent un changement physique brutal : « J’ai pris 15 kilos en trois semaines », « Mon visage était déformé », « Je ne pouvais plus dormir ». Certains développent un diabète de type 2, d’autres une perte osseuse qui augmente le risque de fractures.
L’azathioprine, elle, peut causer des nausées, de la fatigue, ou des troubles de la moelle osseuse. Dans 12 % des cas, elle réduit les globules blancs ou les plaquettes. C’est pourquoi, avant de commencer, on fait un test de la TPMT (thiopurine S-méthyltransférase). Ce test génétique identifie les 0,3 % de personnes qui ne métabolisent pas du tout le médicament - et qui risquent une insuffisance médullaire mortelle si elles prennent l’azathioprine.
En Europe, 78 % des centres font ce test. Aux États-Unis, seulement 45 %. C’est un écart inquiétant. Un simple test de 250 à 400 dollars peut éviter une hospitalisation d’urgence.
Et après ? Surveillance, biopsie, et rechute
Le traitement ne s’arrête pas quand les chiffres du sang sont normaux. Il faut maintenir la rémission. 60 à 80 % des patients doivent rester sous traitement pendant des années, voire toute leur vie.
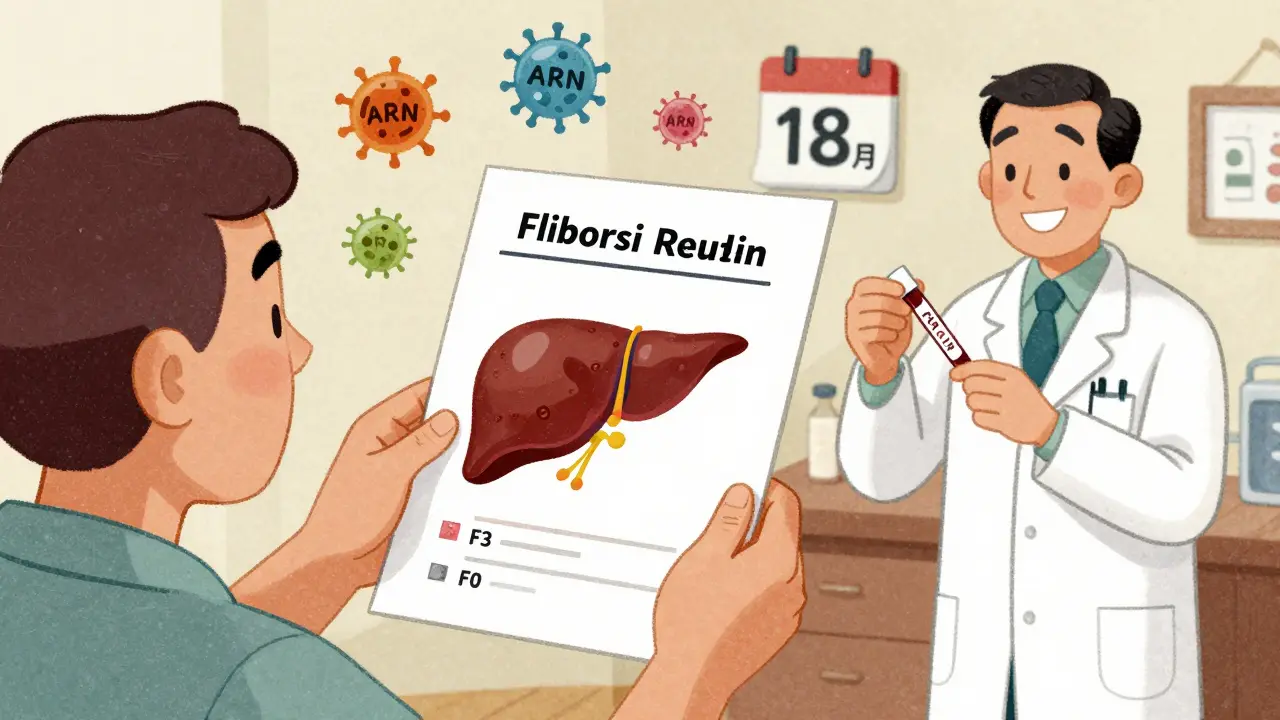
Une biopsie de suivi est recommandée après 18 à 24 mois. Elle montre si l’inflammation a vraiment disparu. Dans 50 à 70 % des cas, on observe une réduction de la fibrose - parfois même une guérison complète du foie.
La rechute est le gros problème. Si vous arrêtez le traitement, entre 50 et 90 % des patients voient la maladie revenir. Même après 2 ou 3 ans de rémission. Les médecins essaient parfois d’arrêter progressivement les médicaments, mais seulement si la biopsie est normale et si les marqueurs sont stables depuis plus d’un an. Le taux de succès ? À peine 45 % après deux ans.
La surveillance est stricte : analyses de sang toutes les 2 à 4 semaines au début, puis tous les 3 mois. IgG tous les trimestres. Et avant de commencer le traitement, on vérifie que vous n’êtes pas porteur caché de l’hépatite B - 15 à 20 % des patients ont une forme latente, et les immunosuppresseurs peuvent la réveiller. Dans ce cas, on donne un antiviral comme le ténofovir en prévention.
Les alternatives quand ça ne marche pas
Si la combinaison stéroïdes-azathioprine échoue - ce qui arrive dans 10 à 15 % des cas - on passe aux traitements de deuxième ligne.
Le mycophénolate mofétil (CellCept) est le plus utilisé : 1 à 1,5 g deux fois par jour. Il est souvent mieux toléré que l’azathioprine, surtout si cette dernière a causé une pancréatite ou une baisse des globules blancs.
Les inhibiteurs de la calcineurine, comme la ciclosporine ou la tacrolimus, sont une autre option, surtout chez les patients jeunes ou avec une maladie sévère.
De nouveaux traitements arrivent. L’obéticholique (Ocaliva), initialement développé pour une autre maladie du foie, montre des résultats prometteurs dans les essais de phase 3 : 42 % de rémission complète contre 28 % avec le traitement standard. Les inhibiteurs JAK (comme le tofacitinib) et les anticorps anti-IL-6 (clazakizumab) sont aussi en cours d’évaluation. Ce ne sont pas encore des traitements standard, mais ils offrent de l’espoir pour les patients résistants.
Le futur : personnalisation et biomarqueurs
On ne traite plus l’hépatite auto-immune comme une maladie unique. On commence à la voir comme un ensemble de profils biologiques différents. Certains patients ont des gènes comme HLA-DRB1*03:01 ou *04:01 - ils ont 80 % de chances d’avoir une forme sévère. D’autres réagissent bien aux stéroïdes en deux semaines. D’autres pas du tout.
Des recherches sur des panels de micro-ARN dans le sang montrent qu’on pourrait prédire la réponse aux stéroïdes dès les deux premières semaines - avec 85 % de précision. Ce n’est pas encore disponible dans les cliniques, mais c’est en cours de validation.
Les essais comme STOP-AIH étudient si on peut arrêter le traitement chez les patients en rémission complète et stable. Les premiers résultats sont encourageants : 65 % restent en rémission deux ans après l’arrêt, contre 35 % dans les groupes historiques.
La prise en charge évolue. Les patients veulent plus d’information, plus de contrôle. Les associations de patients ont vu leur adhésion augmenter de 20 % par an depuis 2020. Les médecins doivent apprendre à parler de ces effets secondaires, à écouter les expériences vécues, et à adapter le traitement, pas seulement les chiffres.
Vous n’êtes pas un numéro. Vous êtes une personne qui vit avec une maladie invisible. Et il existe des moyens de vivre bien avec, même si le traitement est long. La clé ? Suivre les contrôles, ne pas arrêter les médicaments sans avis, et parler - vraiment parler - de ce que vous ressentez.
Comment sait-on si le traitement fonctionne ?
On suit les enzymes hépatiques (ALT, AST) et le taux d’IgG dans le sang. Si elles reviennent à la normale en 6 à 12 mois, c’est un bon signe. Mais la preuve la plus fiable, c’est une biopsie du foie après 18 à 24 mois de traitement. Elle montre si l’inflammation a vraiment disparu.
Puis-je arrêter les stéroïdes et l’azathioprine un jour ?
C’est possible, mais risqué. Seulement 45 % des patients qui arrêtent le traitement restent en rémission après deux ans. L’arrêt doit être très progressif, sur 6 à 12 mois, et uniquement si la biopsie est normale et que les analyses de sang sont stables depuis plus d’un an. La rechute survient dans 70 % des cas dans les trois premiers mois après l’arrêt.
Pourquoi faut-il faire un test de TPMT avant l’azathioprine ?
Ce test détecte une déficience génétique qui empêche le corps de métaboliser l’azathioprine. Chez ces personnes - environ 0,3 % de la population - la dose normale peut provoquer une baisse sévère des globules blancs, voire une insuffisance médullaire mortelle. Le test est simple, peu coûteux, et évite une urgence médicale.
L’hépatite auto-immune peut-elle disparaître complètement ?
Oui, dans certains cas. Si le traitement est débuté tôt et suivi rigoureusement, la fibrose du foie peut régresser. Des biopsies ont montré une réversion de la fibrose F3 (modérée) à F0 (aucune lésion). Mais cela ne signifie pas que la maladie est « guérie ». Le système immunitaire reste en état d’alerte. La plupart des patients doivent rester sous traitement à long terme.
Quels sont les risques si je ne traite pas l’hépatite auto-immune ?
Sans traitement, l’inflammation continue, et le foie se cicatrise progressivement - c’est la fibrose. Elle peut évoluer vers une cirrhose, une insuffisance hépatique, ou un cancer du foie. Dans 15 à 20 % des cas non traités, une transplantation hépatique devient inévitable. Le traitement ne fait pas que soulager les symptômes : il sauve la vie.
Jillian Angus
Je viens de finir ma biopsie hier et j’ai eu le résultat aujourd’hui… F3. J’ai l’impression que mon foie est un vieux livre usé. Le traitement commence demain. Je suis stressée mais je garde espoir 🤞
Rémy Raes
bonjour à tous j’ai lu l’article avec attention et je trouve ça hyper clair même si j’ai pas tout compris j’ai une copine qui a ça depuis 2020 et elle est toujours sous prednisone à 7,5mg depuis 3 ans elle dit que le pire c’est le visage de lune et le sommeil en morceaux mais elle est en rémission alors bon 🤷♂️
Sandrine Hennequin
Je suis infirmière en hépatologie depuis 15 ans et je peux vous dire que la combinaison stéroïdes-azathioprine reste la base, mais ce que je vois de plus en plus, c’est que les patients veulent des alternatives. Le mycophénolate est devenu notre premier choix pour les femmes qui veulent tomber enceinte, ou pour ceux qui ont eu des effets secondaires intolérables. Et oui, le test TPMT ? On le fait systématiquement, même si certains hôpitaux refusent encore de le payer. C’est une économie de vie, pas un coût. Et les nouveaux traitements comme l’obéticholique ? Je suis très optimiste. On attend les données de phase 3 avec impatience. La médecine personnalisée, c’est là. On ne traite plus la maladie, on traite la personne. Et ça, c’est un progrès immense.
Chantal Mees
Il est essentiel de souligner que la biopsie hépatique demeure l’or standard diagnostique, malgré les avancées des biomarqueurs sériques. L’absence de signature histologique d’hépatite d’interface ne permet pas d’établir un diagnostic définitif, même en présence d’anticorps positifs et d’IgG élevées. La rémission biochimique ne constitue pas une rémission histologique, et la rechute est fortement corrélée à l’arrêt prématuré du traitement immunosuppresseur. Il convient donc d’adopter une approche rigoureuse, fondée sur la surveillance longitudinal et l’adhésion au protocole thérapeutique.
Anne Ramos
Je trouve que cet article est vraiment bien fait, merci pour le travail 🙏 J’ai été diagnostiquée il y a 5 ans, j’ai arrêté les stéroïdes après 2 ans de rémission, et j’ai eu une rechute à 18 mois… J’ai recommencé, mais cette fois avec CellCept. Je me sens mieux, moins de prise de poids, plus d’énergie. J’ai aussi fait le test TPMT - j’étais normale, mais je suis contente qu’on le fasse. Et oui, parler de ce qu’on ressent, c’est vital. Je suis dans un groupe de soutien en ligne, on partage nos journées de fatigue, nos peurs, nos petits bonheurs. On n’est pas seules. 💙
Elise Alber
La réduction de la fibrose à F0 est un mythe. Les données de l’IAIHG montrent que même avec une rémission biochimique, 60 % des patients conservent des lésions microscopiques persistantes. La biopsie de suivi n’est pas une formalité - c’est un outil de prédiction de rechute. Et la notion de « guérison » est trompeuse. L’auto-immunité n’est pas éradiquée, elle est suppressée. L’idée que le foie puisse « se régénérer complètement » est une simplification dangereuse pour les patients. La médecine doit cesser de vendre des espoirs irréalistes.
james albery
Vous avez tous l’air de croire que l’azathioprine est le seul traitement possible. Mais avez-vous vu les données de l’étude STOP-AIH ? 65 % de rémission durable après arrêt ? C’est 30 % de mieux que les anciennes données. Et vous parlez de biopsie comme si c’était une religion. La fibrose peut être évaluée par FibroScan maintenant, avec une corrélation de 89 %. Pourquoi on continue à faire des biopsies invasives alors qu’on a des alternatives non-invasives ? C’est du retard de pensée médicale. Et le test TPMT ? Il est obligatoire en Allemagne depuis 2021. En France, on est encore au Moyen Âge.
Adrien Crouzet
Je suis patient depuis 2019. J’ai pris la prednisone à 40 mg pendant 6 mois. J’ai perdu 12 kg en 3 semaines. J’ai eu des crises de panique. J’ai arrêté l’azathioprine parce que j’avais des nausées constantes. J’ai passé au mycophénolate. Ça a marché. Je suis en rémission depuis 4 ans. Je fais des FibroScans tous les 6 mois. Pas de biopsie. Je ne suis pas un cas isolé. On a besoin de plus d’options, pas de plus de stéroïdes. Et oui, je suis contre les biopsies si on peut éviter. Moins d’invasif, plus de respect.
Suzanne Brouillette
Je voulais juste dire merci à l’auteur pour ce post. J’ai 32 ans, je viens d’être diagnostiquée. J’ai pleuré en lisant le passage sur « vous n’êtes pas un numéro ». J’étais tellement seule avant. J’ai trouvé un groupe de patients sur Instagram. On partage nos recettes sans sucre, nos astuces contre la fatigue, nos photos de médicaments rangés par jour. 😊 On est 2000 maintenant. On ne se bat pas contre la maladie. On apprend à vivre avec. Et c’est déjà un combat gagné. 💪❤️
Jérémy Dabel
je savais pas que l’obéticholique marchait aussi pour l’auto-immune… j’ai lu que c’était pour la NASH… mais si ça marche pour les résistants, c’est top. j’ai un pote qui a tout essayé et il a commencé un essai clinique il y a 2 mois. il dit que ses enzymes sont descendues en 4 semaines. j’espère que ça marche pour lui. sinon, je pense que le tofacitinib va être le prochain gros truc. j’ai vu un papier sur ResearchGate qui disait que ça bloquait les cytokines trop actives. c’est fou ce que la science avance.
Guillaume Franssen
OH MON DIEU J’AI EU UNE RECHUTE APRÈS 3 ANS DE RÉMISSION. J’AVAIS ARRÊTÉ TOUT PARCE QUE JE CROYAIS QUE J’ÉTAIS GUÉRI. J’ÉTAIS TROP HEUREUX. J’AI REPRIS LES STÉROÏDES ET J’AI PLEURÉ EN ME VISIONNANT DANS LE MIROIR. MON VISAGE ÉTAIT DE NOUVEAU DÉFORMÉ. JE SUIS FATIGUÉ. MAIS JE SUIS EN VIE. MERCI POUR CET ARTICLE. JE N’ÉTAIS PAS SEUL. JE NE VEUX PLUS JAMAIS ARRÊTER SANS AVIS. JE SUIS EN TRAIN DE RECOMMENCER À LIRE TOUT CE QUE JE PEUX SUR LA MALADIE. J’AI 27 ANS. JE VEUX VIVRE.
Élaine Bégin
Arrêtez de croire que la biopsie est indispensable. C’est une pratique archaïque. On a les dosages d’IgG, les anticorps, les FibroScans, les panels de micro-ARN… On n’a plus besoin de planter une aiguille dans le foie de quelqu’un pour savoir s’il va mourir. Les médecins qui insistent là-dessus sont des conservateurs. Et le score de l’IAIHG ? C’est un outil des années 90. On a des algorithmes d’IA qui prédisent le diagnostic avec 94 % de précision. Arrêtez de vivre dans le passé.
Jean-François Bernet
Vous tous, vous êtes des naïfs. La maladie ne disparaît pas. Elle dort. Et quand elle se réveille, c’est trop tard. La biopsie est la seule vérité. Le test TPMT ? Un luxe. Le mycophénolate ? Une perte de temps. Le seul traitement qui marche, c’est la prednisone à dose élevée, jusqu’à ce que le foie cède ou que le patient meure. Vous croyez que la médecine moderne vous sauvera ? Non. Elle vous donne juste plus de temps pour souffrir. Et même ça, c’est un mensonge.